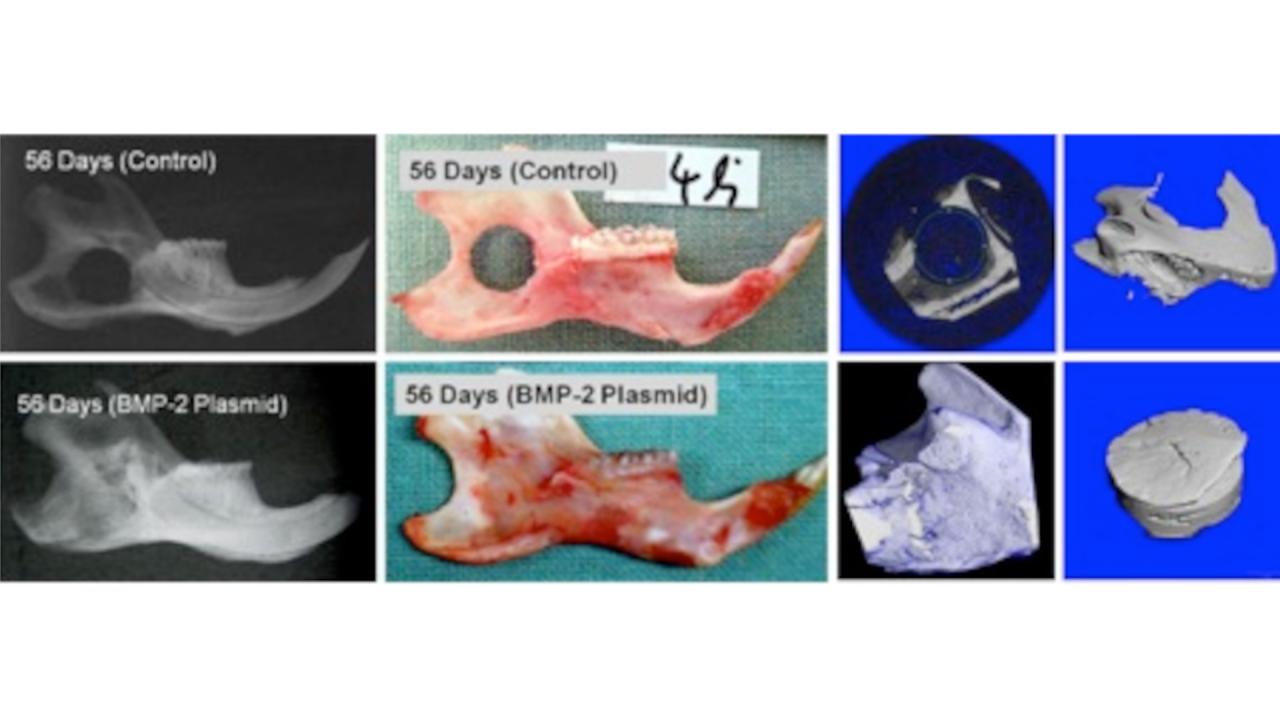
Aufgrund ausgeprägter Verletzungen oder nach Resektion eines Tumors, aber auch im Falle angeborener Fehlbildungen besteht häufig der Bedarf, die Knochenregeneration bzw. –heilung zu fördern. Der Goldstandard war hierfür bisher die Verwendung köpereigenen Knochens, der an verschiedenen Stellen des Körpers entnommen werden kann. Dies ist allerdings mit dem Nachteil einer zusätzlichen, den Patienten belastenden aufwändigen Operation mit nicht unerheblichem Entnahmedefekt verbunden. Seit einigen Jahren besteht nun die Möglichkeit, die Knochenregeneration mittels bestimmter Wachstumsfaktoren zu fördern. Rekombinant hergestellte Wachstumsfaktoren sind aber sehr teuer und führen zum Teil zu unkontrollierter Knochenneubildung. Eine andere Möglichkeit besteht darin, die genetische Information des jeweiligen Wachstumsfaktors zur Knochenbildung in die Zelle zu schleusen. Dies ist am einfachsten mittels eines Virus möglich, das allerdings die jeweiligen Virus-spezifischen Risiken mit sich bringt. Eine Anwendung in der regenerativen Medizin ist deshalb sicher auf absehbare Zeit nicht zu erwarten. Zusammen mit dem Institut für experimentelle Chirurgie und Therapieforschung (Arbeitsgruppe PD Dr. C. Plank) arbeitet unsere Arbeitsgruppe deshalb mit synthetischen, nicht-viralen Plasmiden, die nur lokal und zeitlich begrenzt wirken und vor allem nur transient ins Genom einer Zielzelle integriert werden und damit keine Gefahr einer systemischen Wirkung mit sich bringen. Hierzu wurden genaktivierte Matrices entwickelt, unter denen man Implantatmaterialien versteht, welche als Träger von Genvektoren dienen. Durch Letztere werden im unmittelbaren Implantationsbereich Gewebezellen vorübergehend genetisch programmiert, um einen gewünschten Wachstumsfaktor zu produzieren und damit zur Geweberegeneration beizutragen. Hierdurch wird die körpereigene Regenerationsfähigkeit aktiviert. Mit diesem Konzept kann prinzipiell jeder beliebige Wachstumsfaktor auf jedem beliebigen Implantatmaterial gebildet werden und ein umfassender Bereich in der regenerativen Medizin erschlossen werden. Ein entscheidender Vorteil gegenüber den bisher verwendeten rekombinanten Wachstumsfaktoren ist die länger anhaltende Wirkung. Die aufgrund des schnellen Abbaus rekombinanter Wachstumsfaktoren hohen notwendigen Dosen sind neben deren extremen Kosten einer der wesentlichen Gründe für deren unzureichende Wirkung und daraus folgend seltenem klinischen Einsatz. Die uns zur Verfügung stehenden Plasmide können in verschiedene biodegradierbare Oberflächen integriert werden, welche eine feste Verbindung mit metallischen Implantaten, aber auch resorbierbaren Trägern wie Membranen zulassen. In zahlreichen in vitro- und tierexperimentellen Arbeiten konnte die Wirksamkeit dieses Verfahrens bereits nachgewiesen werden und für diese Technologie bereits „Proof of concept“ mit COPROGs (für BMP-2 kodierend) beschichteten Titanimplantaten erzielt und gezeigt, dass kritische Knochendefekte im Kieferknochen von Ratten geheilt werden können, und dass ebenso beschichtete Dentalimplantate wesentlich besser und schneller einheilen, als Kontrollimplantate. Obwohl das Konzept der genaktivierten Matrix großes Potenzial verspricht besteht grundsätzlich eine konzeptionelle Problematik, die sich aus dem Einsatz von Genen zur Matrixaktivierung ergibt. Die Verwendung von Genen, d.h. in diesem Fall von Plasmid DNA, die für einen Wachstumsfaktor kodiert, birgt das bisher nicht vollständig ausgeschlossene Risiko der genomischen Integration und damit verbunden das der insertionellen Mutagenese und Tumorbildung durch Aktivierung von Protoonkogenen. Dies ist eine extrem seltene, aber im Falle des Auftretens schwerwiegende Nebenwirkung, die es gilt, definitiv auszuschließen bevor etwaige neue therapeutische Systeme insbesondere in der regenerativen Medizin zugelassen werden können. Aus diesen Überlegungen heraus ist es offensichtlich, dass weitere Konzepte notwendig sind, die dieses unkalkulierbare Risiko gänzlich ausschließen. Weitere angestrebte Inovationen gehen deshalb dahin, erstmalig mit Hilfe von mRNA jegliches Risiko der insertionellen Mutagenese gänzlich auszuschließen. Bei diesem Konzept soll die Plasmid DNA durch mRNA (das Transkript) als kodierende Nukleinsäure ersetzt.
Zur Verbesserung der chirurgischen Therapie und des perioperativen Managements ist es notwendig die Qualität und Quantität des Knochenwachstums, der Knochenneubildung und des Knochenremodellings zu analysieren. Unsere Arbeitsgruppe verwendet hierzu eine Vielzahl von mittlerweile optimierten Techniken zur Verfügung.
Zur Bestimmung von Volumen, Dichte und weiterer struktureller und morphometrischer Parameter des originären und neu gebildeten Knochens nutzen wir die Computertomographie. Dabei kommt zum einen das konventionelle Multi-Slice-CT zum Einsatz, zum andern können durch die Verwendung eines µ-CT detaillierte 3D-Rekonstruktionen in einer Auflösung von bis zu 4µm angefertigt werden. Diese Technik ermöglicht zudem eine nahezu artefaktfreie Darstellung der Übergangszone zwischen dem Knochen und enossalen Implantaten.
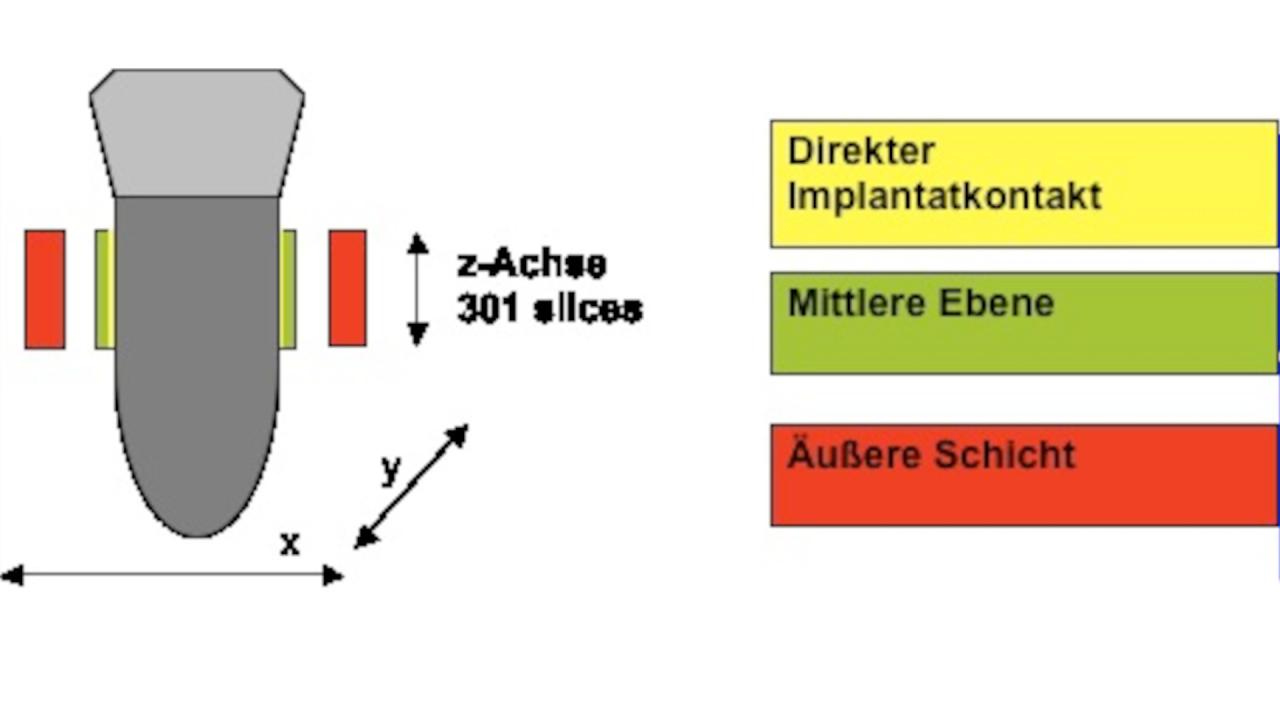
Der entscheidende und bisher nicht vollständig gelöste Problempunkt z. B. im Zusammenhang mit der Erfassung des dreidimensionalen Interfaces, also der knöchernen Architektur unmittelbar an der Verbindung zwischen Implantat und Knochen ist die Artefaktbildung an dieser Grenzfläche, wodurch entscheidende Strukturen nicht zur Darstellung kommen und die wesentliche Aussage zur Einheilungsrate eines metallischen Implantates nicht möglich ist. Bisherige Literaturangaben geben eine maximale, Artefaktfreie Annäherung von 30 µm an das Implantat heran an. Ein weiteres Feld der Arbeitsgruppe besteht deshalb in der Entwicklung neuer Algorithmen bzw. individueller Skripten, die gegenüber den bisher publizierten Daten eine Elimination nahezu aller Artefakte ermöglicht und vollautomatisch den Knochen detektiert und gleichzeitig Titan von Knochen in Abhängigkeit vom Abstand zueinander (bzw. der Artefakte) trennt [Abb. 2]. Es erlaubt uns, folgende Parameter sinnvoll und dauerhaft reproduzierbar zu bestimmen: Bone volume/Total volume (BV/TV); Attachpercent Implant (BV/TV Implantat); connectivity density (CD); trabecular thickness (Tb. Th.); degree of anisotropy (DA); bone surface (BS); structure model index (SMI). In der anschließenden optischen Wiedergabe der Messungen wurde zur Differenzierung des Knochens vom Titan eine farbkodierte Dichtedarstellung gewählt, welche auf der Helligkeitsverteilung der Voxel basiert [Abb. 3].
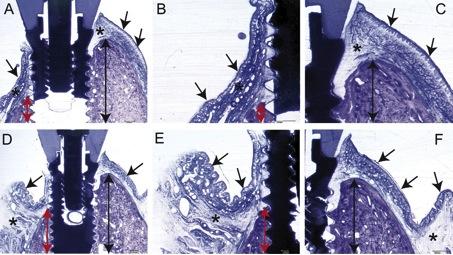
Mittels Histologie und Histomorphometrie kann die Qualität des Knochens, und insbesondere struktuelle Veränderungen der Knochenmatrix, die Vaskularisation des neugebildeten Knochens beurteilt werden. Es erfolgt die Einbettung mit Technovit 9100®, um entsprechende Immunhistologie und Detektierung verschiedener Fluorochrome mit demselben Präparat zu gewährleisten [Abb. 4]. Dafür stehen uns verschiedene Färbetechniken zur Verfügung. Toluidinblau: Standardfärbung zur Oberflächenanfärbung [Abb. 4], Hämatoxylin-Eosin: Standardfärbung für entkalter Präparate zur Darstellung basophilen und azidophilen Strukturen. Levai-Laczko: Unterschied zwischen ortsständigen und neu gebildeten Knochen. von Kossa: Knochen- und Knorpelgewebe in Kontrast zu den übrigen Bestandteilen wie Osteoid und bindegewebigen Strukturen. Trichrom-Masson-Goldner: Standardfärbung für nicht entkalkte Knochenpräparate zur differenzierten Darstellung von mineralisiertem und nicht-mineralisiertem Knochengewebe und der davon klar abzugrenzenden Färbbarkeit der Weichteilstrukturen wie Bindegewebe und Muskulatur.
Die Darstellung des zeitlichen Ablaufs des Knochenwachstums kann mittels der Polychromen Sequenzmarkierung erreicht werden. Hierbei werden zu definierten Zeitpunkten fluoreszierende Substanzen verabreicht die im Rahmen der histologischen Auswertung anhand ihrer Farbe den genauen Zeitpunkten der Knochenneubildung zugeordnet werden können. Durch die Verwendung neuartiger spektralanalytischer Bildaufnahmetechniken und der konfokalen Laser Scanning Mikroskopie konnten Fortschritte in der mikroskopischen Auswertung bei der polychromen Sequenzmarkierung von Knochen erzielt werden. Eine Übertragung dieser Methode auf den Menschen erscheint darüber hinaus grundsätzlich möglich. Ein erster Ansatz ist hierbei die Fluoreszenzmarkierung von Knochen zur intraoperativen makroskopischen Detektion von nekrotischem Knochen [Abb. 5-7].
Proof of principle des GAM – Konzeptes mit Plasmiden
Erfassung des dreidimensionalen Interfaces, also der Verbindung zwischen Implantat und Knochen, Artefaktbildung an der Grenze des Implantates kann dazu führen, dass entscheidende Strukturen nicht zur Darstellung kommen. Abhilfe schaffen kann hier eine Art Segmentierung mit individueller Einstellung einer unterschiedlichen Threshold der zu messenden Knochenstrukturen in Abhängigkeit vom Abstand des Knochens zum Implantat.
µCT-Messungen von Implantatoberflächen

Histologische Evaluation der Implantateinheilung (Toluidinblau)
Polychrome Sequenzmarkierung
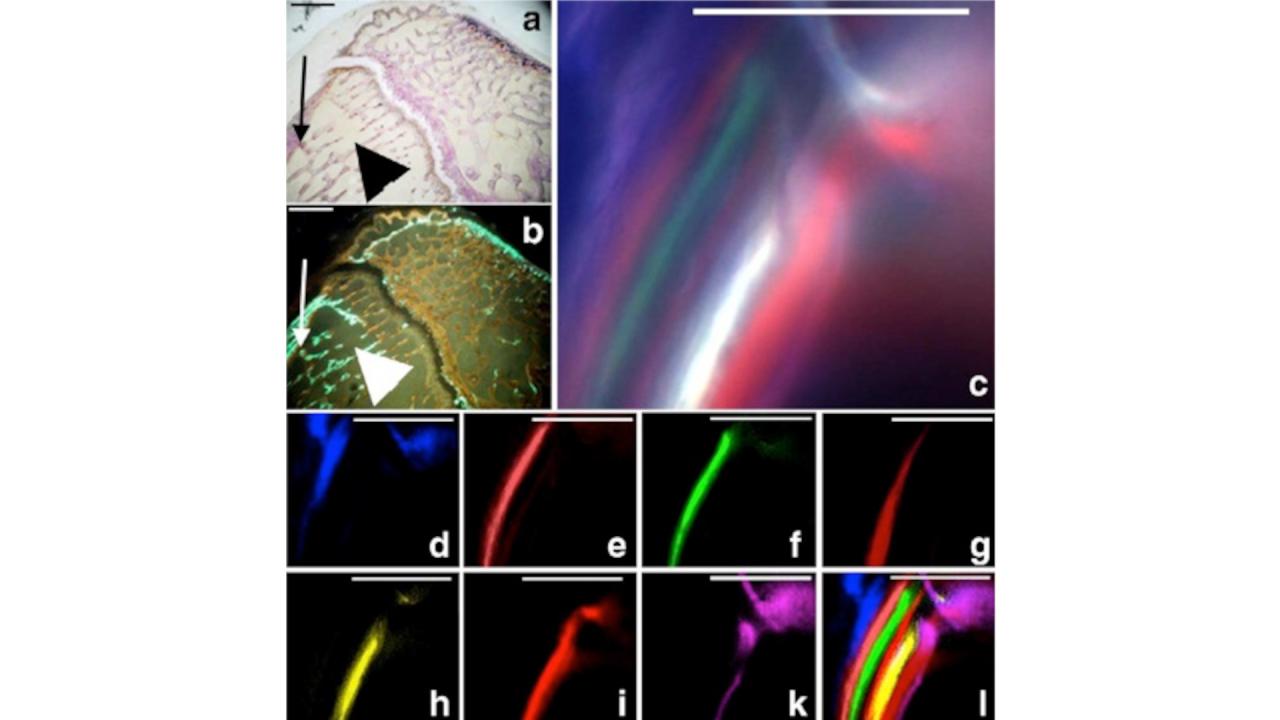
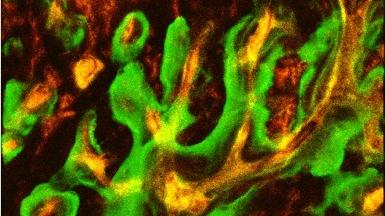
Polychrome Sequenzmarkierung mit verschiedenen Tetracyclinderivaten, 20x, CLSM 510 NLO Meta
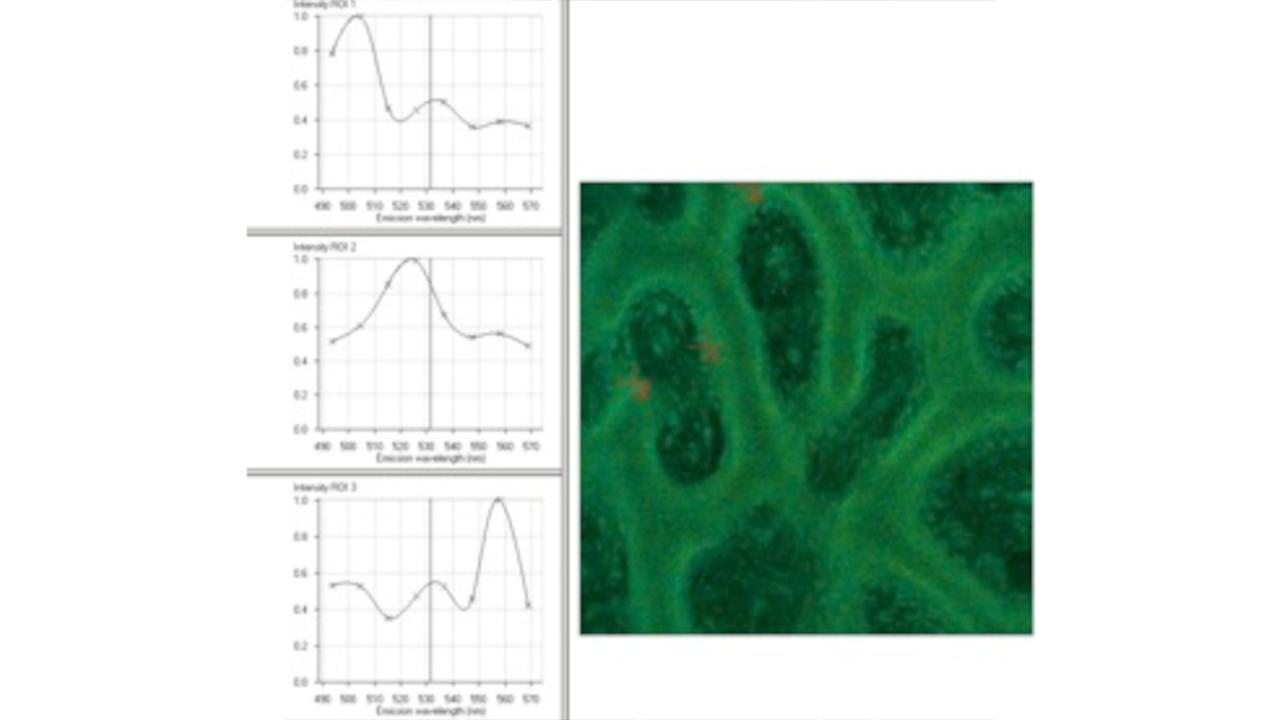
Polychrome Sequenzmarkierung mit verschiedenen Tetracyclinderivaten, Extraktion der Fluoreszenspektren mittels ACE, 20x, CLSM 510 NLO Meta
Smeets R, Gerhards F, Maciejewski O, Riediger D, Pautke C, Weitz J, Stein J, Kolk A. A novel hemostatic delivery device for thrombin: Biodegradable poly (D, L-lactide-co-glycolide) 50:50 microspheres. J Control Release. Under review
Smeets R, Maciejewski O, Gerressen M, Spiekermann H, Hanisch O, Riediger D, Blake F, Stein J, Hölzle F, Kolk A. Impact of rhBMP-2 on regeneration of buccal alveolar defects during the osseointegration of transgingival inserted implants. Oral Surg Oral Med Oral Pathol Oral Radiol Endod. 2009 Oct;108(4):e3-e12
Pautke C, Kolk A, Brokate M, Wehrstedt JC, Kneissl F, Miethke T, Steinhauser E, Horch HH, Deppe H. Development of novel implant abutments using the shape memory alloy nitinol: preliminary results. Int J Oral Maxillofac Implants. 2009 May-Jun;24(3):477-83
Pautke C, Tischer T, Vogt S, Haczek C, Deppe H, Neff A, Horch HH, Schieker M, Kolk A. New advances in fluorochrome sequential labelling of teeth using seven different fluorochromes and spectral image analysis. J Anat. 2007 Jan;210(1):117-21
Horch HH, Sader R, Pautke C, Neff A, Deppe H, Kolk A. Synthetic, pure-phase beta-tricalcium phosphate ceramic granules (Cerasorb) for bone regeneration in the reconstructive surgery of the jaws. Int J Oral Maxillofac Surg. 2006 Aug;35(8):708-13
Pautke C, Vogt S, Tischer T, Wexel G, Deppe H, Milz S, Schieker M, Kolk A. Polychrome labeling of bone with seven different fluorochromes: enhancing fluorochrome discrimination by spectral image analysis. Bone. 2005 Oct;37(4):441-5
Institut für Experimentelle Onkologie und Therapieforschung
TUM Department of Tissue morphology
AO Foundation
Davos Arbeitsgruppe Tissue Engineering Knochen (AGTEK)
LMU München Abteilung und Poliklinik für Sportorthopädie, TUM
Institut für Experimentelle Onkologie und Therapieforschung, TUM
Department of Tissue morphology, AO Foundation, Davos
Arbeitsgruppe Tissue Engineering Knochen (AGTEK), LMU München
Klinik und Poliklinik für Orthopädie und Sportorthopädie, TUM
Anatomische Anstalt, LMU München
Light Microscopy Centre, ETH Zürich
IMETUM, TUM